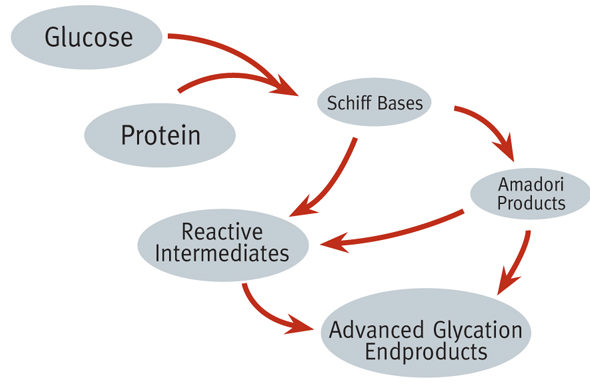
Gli AGEs (Advanced Glycation End products) si formano come risultato del processo di glicazione. Questi sono glicoproteine deformate che hanno perso la loro funzione originaria e si producono spontaneamente in un ambiente ad alta concentrazione di zuccheri [1]. Tale ambiente può essere favorito nel nostro organismo da deficit nei meccanismi di regolazione glicemica.
La malattia di Alzheimer è la forma più comune di demenza neurodegenerativa e altamente invalidante con esordio prevalentemente intorno ai 65 anni. I sintomi più frequenti riguardano la memoria, specialmente di eventi recenti e l’orientamento spaziale. Con l’avanzare della malattia i deficit cognitivi coinvolgono anche la capacità di comporre e capire il linguaggio, di prendere decisioni, la comprensione dei concetti di spazio e tempo, e la presenza di disturbi della condotta, affettivi, psicotici e comportamenti specifici come vagabondaggio, agitazione, aggressività, contribuiscono a peggiorare ulteriormente il livello di autonomia della persona nelle attività della vita quotidiana. La malattia porta lentamente il malato a isolarsi dalla società e dalla famiglia e nei peggiori dei casi all’istituzionalizzazione.
AGEs e Alzheimer: in che modo la dieta o un deficit dei meccanismi di regolazione glicemica è collegato alla più diffusa patologia neurodegenerativa?
I prodotti della glicazione sono molecole che si trovano, per esempio, sulle superfici abbrustolite dei cibi fritti, grigliati e anche sul pane tostato. Oltre al colore, gli AGE conferiscono agli alimenti cotti sapore e aroma, tipici dei prodotti da forno, dei derivati del latte, della carne e del pesce.
Le reazioni di glicazione sono necessarie per il corretto funzionamento di alcune molecole ma in quantità elevate, il loro prodotto diventa tossico e dannoso per la nostra salute. Quando c’è un’elevata concentrazioni di zuccheri nel sangue, le reazioni di glicazione possono diventare incontrollabili. Il glucosio reagisce con le proteine presenti nel sangue e nei tessuti generando molecole biologicamente inattive, gli AGEs appunto. L’origine degli AGEs può essere sia di natura endogena che introdotte nel nostro organismo con il cibo e la loro sintesi può essere promossa anche da malsane abitudini come il fumo.
Oggi con la dieta consumiamo più AGE di quanto accadeva diversi anni fa. La maggior quantità di queste molecole si forma e si accumula durante le fasi di cottura degli alimenti. La loro formazione dipende dalla temperatura, dal tipo di cottura, dalla composizione in proteine, zuccheri e dagli oli utilizzati. Inoltre, l’eccessiva trasformazione alimentare e l’aggiunta di esaltatori del sapore aumenta la quantità di AGE presente nei cibi che regolarmente assumiamo.
Gli alimenti come la carne, i prodotti da forno, i cibi fritti, i cereali raffinati, i formaggi, sono quelli da consumare con più cautela. Mentre livelli più bassi di AGEs si riscontrano nel pesce, negli ortaggi, nei legumi, nella frutta e nei cereali integrali.
Queste molecole, gli AGEs, possono impedire ai neuroni di funzionare correttamente. In una ricerca del 2013 i ricercatori riportano che il cervello delle persone con malattia di Alzheimer ha livelli elevati di AGEs che contribuiscono alla formazione delle placche amiloidi – un’alta percentuale delle persone malate di Alzheimer soffrono di diabete di tipo II (Fukazawa R. et al.2013) e uno studio del 2018 ha dimostrato che la presenza di diabete di tipo II fa aumentare il rischio che si sviluppi la malattia di Alzheimer. (Keivan Javanshiria, 2018).
Shannon e colleghi, in uno studio del 2015, ipotizzano che fra diabete e malattia di Alzheimer ci possa essere un legame: livelli elevati di glucosio nel sangue, infatti, possono far aumentare rapidamente i livelli di beta-amiloide.
Per capire in che modo valori di glicemia elevati possano influenzare il rischio di malattia di Alzheimer, i ricercatori hanno sottoposto a infusioni di glucosio dei topi. Hanno così scoperto che nei topi giovani, senza placche amiloidi nel cervello, un raddoppio dei livelli della glicemia portava a un aumento dei livelli di beta-amiloide nel cervello del 20%. Quando l’esperimento è stato ripetuto nei topi anziani, che già avevano sviluppato placche cerebrali, i livelli di beta-amiloide sono aumentati del 40%.
Con queste premesse alcuni ricercatori hanno iniziato a riferirsi al legame tra le due condizioni, tra diabete e Alzheimer, come “diabete di tipo 3”. Il termine “diabete di tipo 3” è stato coniato per la prima volta da ricercatori che hanno scritto nel Journal of Alzheimer’s Disease nel 2005.
Di contro, in una ricerca basata su 268 pazienti deceduti di età superiore ai 65 anni, i ricercatori hanno analizzato dei campioni di cervello per confermare la diagnosi di demenza, utilizzando le cartelle cliniche e il Registro Nazionale Svedese del diabete per determinare se i soggetti analizzati soffrivano di ipertensione, diabete, o di entrambi le patologie. I ricercatori hanno riscontrato un’elevata presenza di ipertensione e di diabete di tipo II tra i soggetti con demenza vascolare e demenza mista, mentre nei soggetti con malattia di Alzheimer hanno riscontrato una frequenza inferiore delle due patologie. (Javanshiri K et al. 2018)
I risultati di quest’ultimo studio sembrerebbero indicare che l’associazione tra Alzheimer e diabete di tipo II sia giustificata più dalle diffusa presenza di queste patologie nella popolazione over 65 anni che da una relazione diretta tra Alzheimer e iperglicemia.
È opinione di chi scrive che, in ogni caso, evitare il consumo di zuccheri e i cibi troppo elaborati, preferendo una dieta vegetariana sia una scelta altamente consigliata, specialmente dopo i 40 anni di età.
Fonti consultate.
Ahn, S. M., Byun, K., Cho, K., Kim, J. Y., Yoo, J. S., Kim, D., … & Lee, B. (2008). Human microglial cells synthesize albumin in brain. PloS one, 3(7), e2829.
Byun, K., Yoo, Y., Son, M., Lee, J., Jeong, G. B., Park, Y. M., … & Lee, B. (2017). Advanced glycation end-products produced systemically and by macrophages: A common contributor to inflammation and degenerative diseases. Pharmacology & therapeutics, 177, 44-55.
Dhananjayan, K., Forbes, J., & Münch, G. (2018). Advanced glycation, diabetes, and dementia. In Type 2 Diabetes and Dementia (pp. 169-193). Academic Press.
Fukazawa, R., Hanyu, H., Sato, T., Shimizu, S., Koyama, S., Kanetaka, H., … & Iwamoto, T. (2013). Subgroups of Alzheimer’s disease associated with diabetes mellitus based on brain imaging. Dementia and geriatric cognitive disorders, 35(5-6), 280-290.
Javanshiri, K., Waldö, M. L., Friberg, N., Sjövall, F., Wickerström, K., Haglund, M., & Englund, E. (2018). Atherosclerosis, hypertension, and diabetes in Alzheimer’s disease, vascular dementia, and mixed dementia: Prevalence and presentation. Journal of Alzheimer’s Disease, 65(4), 1247-1258.
Macauley, S. L., Stanley, M., Caesar, E. E., Yamada, S. A., Raichle, M. E., Perez, R., … & Holtzman, D. M. (2015). Hyperglycemia modulates extracellular amyloid-β concentrations and neuronal activity in vivo. The Journal of clinical investigation, 125(6), 2463-2467.
Sanz, C. M., Hanaire, H., Vellas, B. J., Sinclair, A. J., Andrieu, S., & REAL. FR Study Group. (2012). Diabetes mellitus as a modulator of functional impairment and decline in Alzheimer’s disease. The Real. FR cohort. Diabetic Medicine, 29(4), 541-548.
Takeuchi, M., Kikuchi, S., Sasaki, N., Suzuki, T., Watai, T., Iwaki, M., … & Yamagishi, S. I. (2004). Involvement of advanced glycation end-products (AGEs) in Alzheimer’s disease. Current Alzheimer Research, 1(1), 39-46.
Vlassara, H., Woodruff, S., & Striker, G. E. (2016). Dr. Vlassara’s AGE-Less Diet: How a Chemical in the Foods We Eat Promotes Disease, Obesity, and Aging and the Steps We Can Take to Stop It. Square One Publishers, Inc..
Zhao, W. Q., & Townsend, M. (2009). Insulin resistance and amyloidogenesis as common molecular foundation for type 2 diabetes and Alzheimer’s disease. Biochimica et Biophysica Acta (BBA)-Molecular Basis of Disease, 1792(5), 482-496.
Zhao, W. Q., & Townsend, M. (2009). Insulin resistance and amyloidogenesis as common molecular foundation for type 2 diabetes and Alzheimer’s disease. Biochimica et Biophysica Acta (BBA)-Molecular Basis of Disease, 1792(5), 482-496.
Questo articolo nasce con intento divulgativo. Eventuali semplificazioni sono volute al fine di renderlo di più facile lettura e comprensione.

